Ptá se: RNDr, Zuzana Krátká, PhD.; imunolog
Odpovídá: plk. gšt. MUDr. Miloš Bohoněk, Ph.D., primář Oddělení hematologie a krevní transfuze, Ústřední vojenské nemocnice – Vojenské fakultní nemocnice v Praze
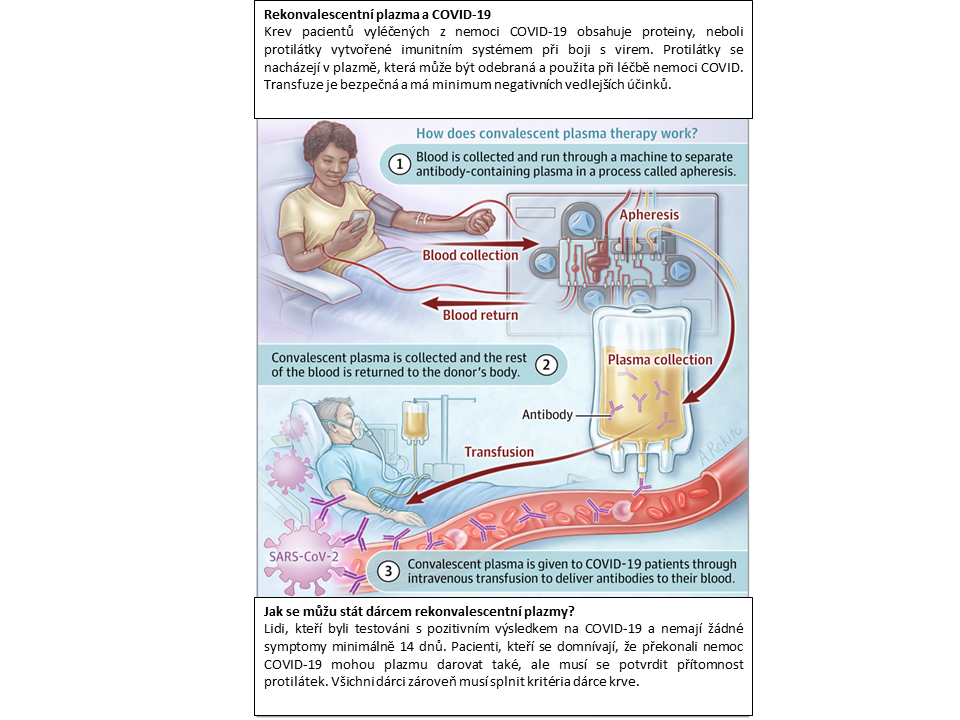
Mnoho pacientů, kteří závažně onemocněli COVID-19, bylo léčeno plazmou osob, které prodělaly toto onemocnění. Hlavní léčivou složkou rekonvalescentní plazmy jsou neutralizační protilátky. Jak dlouho se rekonvalescentní plazma používá k léčbě různých onemocnění a kolik pacientů bylo pomocí ní v ČR zatím léčeno?
Výroba rekonvalescentní plazmy (RP) od osob, které prodělaly onemocnění COVID-19, se v době pandemie infekce novým koronavirem SARS-CoV-2 stala zvláštní a novou kapitolu v léčbě infekčních onemocnění v řadě zemí, včetně České republiky, i když se jedná o postup známý již více než 100 let. Podání anti-SARS-CoV-2 protilátek obsažených v této plazmě je způsob pasivní specifické imunizace s očekávatelnou léčebnou odpovědí a RP se na počátku pandemie stala jednou z velmi rychle dostupných léčebných alternativ. Zkušenosti z předchozích epidemických nákaz způsobených koronaviry SARS-CoV-1 a MERS-CoV naznačovaly, že RP obsahuje neutralizační protilátky proti příslušnému viru, které jsou pravděpodobně hlavním zdrojem jejího léčebného potenciálu. Nelze ale vyloučit ani další imunitní mechanismy, jako je protilátkami indukovaná buněčná cytotoxicita a/nebo fagocytóza [1-6].
Plazma odebraná pacientům, kteří se zotavili z infekčního onemocnění, byla v minulosti mnohokrát s úspěchem používána pro profylaxi nebo léčbu řady infekčních onemocnění, i když důkazy o účinnosti a bezpečnosti tohoto postupu byly většinou omezeny pouze na empirické zprávy [7]. Specifické imunoglobuliny jsou do dnešní doby účinnou terapií a profylaxí mnoha virových onemocnění (např. vztekliny, hepatitis A i B, kongenitální cytomegalovirové infekce a dalších) [8]. První rozsáhlejší použití RP bylo popsáno v období pandemie španělské chřipky (H1N1) v letech 1918-1920 a s jejím použitím bylo uváděno snížení smrtnosti chřipkové pneumonie [9]. Z posledních epidemických onemocnění před pandemií SARS-CoV-2 se RP používala k léčbě virové horečky ebola, blízkovýchodního respiračního syndromu, ptačí chřipky, pandemické chřipky H1N1 a infekce SARS-CoV-1 [10,11,12]. Naděje vkládané do RP v boji s novým koronavirem byly legitimní a v řadě zemí se výroba a použití RP stala doslova národním programem a jednou z léčebných strategií. Účinnost RP byla průběžně potvrzována různými klinickými studiemi (např. Joyner a kol. [13], Libster a kol. [14]) zejména tehdy, pokud byla podána včas (do 3 dnů od diagnózy), ještě před rozvojem závažných klinických projevů a vytvořením protilátkové odpovědi u pacienta. Výroba RP byla podporovaná i ze strany EU průběžně aktualizovaným doporučením [15].
Na druhou stranu se oproti optimistickým zprávám stále častěji objevovaly studie, které pro účinnost RP při léčbě onemocnění COVID-19 její jednoznačný terapeutický přínos nepotvrzovaly [16,17, 18] a nedostatek robustní evidence pro použití RP v léčbě COVID-19 spolu s nástupem principiálně shodné, ale bezpečnější, léčby monoklonálními protilátkami (Bamlanivimab, Regeneron) byl začátkem léta 2021 důvodem útlumu tohoto programu.
V České republice byla výroba RP od osob, které prodělaly onemocnění COVID-19, zahájena koncem března 2020 a v dubnu 2020 byla RP transfundována prvním pacientům [19] a cestou Klinické skupiny COVID MZ a dále pak mezioborových doporučení byla její výroba a indikace upřesňována a v souladu s mezinárodními a domácími zkušenostmi léčba směřována do začátku onemocnění jako profylaktická, k zabránění rozvoje závažných stavů.
Do výroby RP se v průběhu let 2020-21 postupně zapojilo celkem 24 zařízení transfuzní služby (ZTS), kdy největší problém představovalo vyšetření protilátkové odpovědi u dárců z důvodu obtížné dostupnosti „originálního“ virus neutralizačního testu (VNT) a jeho doplnění, resp. náhrada komerčním sérologickým testem představovalo velkou odbornou výzvu. Problém byl zejména v tehdy neexistujícím standardu VTN a obtížně nalezitelné korelaci se sérologickými testy na bázi imunoesejí. Pro praxi výroby RP byla nakonec použita korelační tabulka FDA USA, uvedená v posledním mezioborovém stanovisku na toto téma z března 2021. V období duben 2020 – duben 2021 bylo v ČR vyrobeno celkem 19 079 T.U. RP ve 24 ZTS a z tohoto vyrobeného množství bylo vydáno 14 197 T.U. pro cca 7 100 pacientů v 61 nemocnicích. Rekonvalescentní plazma byla podána 5,4 % pacientů z celkového počtu 131 000 hospitalizovaných osob.
V současnosti probíhá v ČR sběr dat k retrospektivní studii RESOVID-19 (Retrospektivní studie účinnosti a bezpečnosti rekonvalescentní plazmy anti-SARS-CoV-2 při léčbě onemocnění covid-19), kterou zpracovala ÚVN Praha a ke které se přihlásilo cca 10 dalších nemocnic. Cílem studie je ověřit nebo vyloučit účinnost RP a její případný vliv na výskyt nežádoucích událostí u pacientů.
Použití protilátek, které vznikly na základě přirozené imunizace nebo které byly vyrobeny biotechnologickými postupy, je léty ověřená praxe v léčbě, resp. prevenci zhoršení různých onemocnění. Bohužel standardizace léčiva vyráběného z čerstvě odebrané lidské plazmy je velmi obtížná a jeho kvalita závisí na obsahu účinné látky (protilátek). Přes nesporné dílčí klinické úspěchy se zatím nepodařilo dle současného pojetí EBM získat dostatečně robustní důkazy o účinnosti RP. Rozhodně se ale nemusí jednat o ukončenou kapitolu a standardizace testu VNT se serologickými vyšetřeními protilátek by mohla pomoci lépe definovat množství protilátek v podávané plazmě. Velkou výhodou léčby pomocí RP je totiž skutečnost, že můžeme volbou plasmy reagovat na různé varianty viru, tj. můžeme podat plasmu získanou od pacientů po onemocnění příslušnou mutací viru.
V každém případě léčba pomocí RP potvrzuje relevantnost protilátkové odpovědi získané přirozenou imunizací a slouží jako významný důkaz pro uznání laboratorně prokázané protilátkové odpovědi jako projevu přetrvávající imunity. Dořešit zbývá pouze jak vysoké mají být uznávané protilátky, protože každý komerčně dostupný sérologický test používá jiné jednotky a hodnoty. Nicméně i k tomu lze využít zkušenosti z výroby a použití RP a například přepočet zmíněné korelační tabulky FDA na průběrný krevní objem.
Literatura
- Woo PCY, Lau SK, Wong BH et al. Longitudinal Profile of Immunoglobulin G (IgG), IgM, and IgA Antibodies against the Severe Acute Respiratory Syndrome (SARS) Coronavirus Nucleocapsid Protein in Patients with Pneumonia Due to the SARS Coronavirus. Clin and Diag Lab Imunology 2004; 11: 665-668.
- Cheng Y, Wong R, Soo YO et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis 2005; 24: 44-46.
- Yeh KM, Chiueh TS, Siu LK et al. Experience of using convalescent plasma for severe acute respiratory syndrome among healthcare workers in a Taiwan hospital. J Antimicrob Chemother 2005; 56: 919-922.
- Zhang JS, Chen JT, Liu YX et al. A serological survey on neutralizing antibody titer of SARS convalescent sera. J Med Virol 2005; 77: 147-150.
- Arabi YM, Hajeer AH, Luke T et al. Feasibility of Using Convalescent Plasma Immunotherapy for MERS-CoV Infection, Saudi Arabia. Emerg Infect Dis 2016; 22: 1554-1561.
- Mair-Jenkins J, Saavedra-Campos M, Baillie JK et al. The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis. J Infect Dis 2015; 211: 80-90.
- Garraud O, Heshmati F, Pozzetto B et al. Plasma therapy against infectious pathogens, as of yesterday, today and tomorrow. Transfus Clin Biol 2016; 23: 39-44.
- Casadevall A, Dadachova E, Pirofski LA. Passive antibody therapy for infectious diseases. Nat Rev Microbiol 2004;2: 695-703.
- Luke TC, Kilbane EM, Jackson JL, Hoffman SL. Meta-analysis: convalescent blood products for Spanish influenza pneumonia: a future H5N1 treatment? Ann Intern Med 2006; 145: 599-609.
- Hung IF, To KK, Lee CK et al. Convalescent plasma treatment reduced mortality in patients with severe pandemic influenza A (H1N1) 2009 virus infection. Clin Infect Dis 2011; 52: 447-456.
- World Health Organisation. Use of Convalescent Whole Blood or Plasma Collected from Pacients Recovered from Ebola Virus Disease for Transfusion, as an Empirical Treatment during Outbreaks, WHO Interim Guidance for National Health Authorities and Blood Transfusion Services, Version 1.0, September 2014, WHO/HIS/SDS/2014.8. Dostupné na: https://apps.who.int/iris/handle/10665/135591
- Sahr F, Ansumana R, Massaquoi TA et al. Evaluation of convalescent whole blood for treating Ebola Virus Disease in Freetown, Sierra Leone. J Infect 2017; 74: 302-309.
- Joyner MJ, Senefeld JW, Klassen SA et al. Effect of Convalescent Plasma on Mortality among Hospitalized Patients with COVID-19: Initial Three-Month Experience. Preprint. medRxiv 2020; 2020.08.12.20169359.
- Libster R, Pérez Marc G, Wappner D, et al. Early High-Titer Plasma Therapy to Prevent Severe Covid-19 in Older Adults. N Engl J Med. 2021:NEJMoa2033700. doi:10.1056/NEJMoa2033700.
- European Commision. An EU Programme of COVID-19 convalescent plasma collection and transfusion. Dostupné na: https://ec.europa.eu/health/sites/health/files/blood_tissues_organs/docs/guidance_plasma_covid19_en.pdf
- Simonovich VA et al., A Randomized Trial of Convalescent Plasma in Covid-19 Severe Penumonia, N Engl J Med 2021; 384:619-623, doi: 10.1056/NEJMoa2031304
- Agarwal A et al., Convalescent plasma in the management of moderate covid-19 in adults in India: open label phase II multicentre rendomised controlled trial (PLACID Trial), BMJ 2020;371:m3939, http://dx.doi.org/10.1136/bmj.m3939
- RECOVERY Collaborattive Group, Convalescent plasma in patitnts admitted to hospitl with COVID-19 (RECOVERY): a randomised controlled, open-label, platform trial, Lancet 2021; 397:2049-59
- Bohoněk M., Řezáč D., Holub M., Výroba a použití rekonvalescentní plazmy pro léčbu COVID-19 s přihlédnutím ke zkušenostem v ÚVN Praha, Čas. Lék. čes., 2020; 159: 175–180
